植物病原糸状菌の感染戦略を解明する
植物の免疫システム
様々な微生物が共通に持つ生体構成物質、例えば細胞壁成分や分泌タンパク質などを総称して微生物関連分子パターンといい、植物はこれらを感知することでパターン誘発型免疫(pattern-triggered immunity; PTI)と呼ばれる防御反応を誘導します。多くの微生物はこのPTIによる防御のために感染できないのです。「植物に病気を引き起こす微生物」=「病原菌」なのですが、病原菌はエフェクターと呼ばれる病原性因子を植物細胞内に多数注入してPTIを抑制しているために、感染して増殖することができるわけです。それに対して植物はやられっぱなしというわけではなく、病原菌に対して抵抗性を持つものもいます。その抵抗性植物では、抵抗性(resistance; R)タンパク質と総称されるタンパク質群がこれらのエフェクターを認識して、爆発的な活性酸素種の生成(オキシダティブバースト)、感染部位の自律的細胞死、防御遺伝子の発現、抗菌物質の蓄積などを急速に強く引き起こして防御します。これらの反応を過敏感反応(hypersensitive response; HR)といいます。エフェクターを認識することで誘導される防御反応をエフェクター誘発型免疫(effector-triggered immunity; ETI)とも呼びます。さらに感染していない葉にそのシグナルが伝えられ、二次感染に備えるための全身獲得抵抗性(systemic acquired resistance; SAR)が誘導されます。最近ではこのような多層の防御システムを『植物免疫』と呼ぶようになってきました。
うどんこ病菌
謎多き病原菌
うどんこ病は様々な植物で発症する病気ですが、うどんこ病菌というカビが引き起こしています。見た目でうどんこ病とわかりやすいため、主に農薬を使って防除しています。農薬を使うのが当たり前になっていますが、薬剤耐性菌が発生して効果が薄くなってきているためさらに使用量を増やすという悪循環になりつつあります。環境のことを考えると今後はむしろ使用量を減らしていかなければなりません。地球の将来を考えると、当たり前に発生し、当たり前に農薬を使っているうどんこ病こそ、農薬を使わないで済む防除方法を開発しなければなりません。新病害にばかり気を取られていてはいけません。
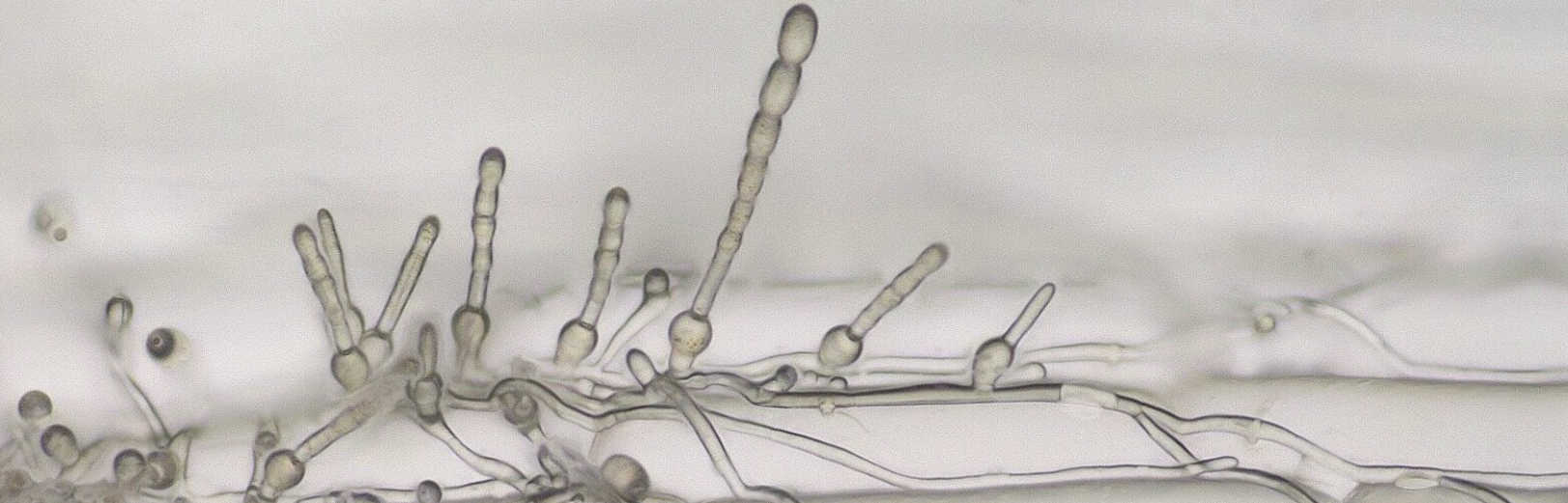
うどんこ病菌は、地球上に約900種存在しており、1万種以上の植物に感染することが知られています。とはいえ、宿主特異性という特定の宿主植物のみに感染するという性質があるのでなんでもかんでも感染してしまうということはありません。例えば、オオムギに感染するうどんこ病菌はキュウリには感染できない、その逆もまた然り。絶対寄生性という面白い特徴もあり、生きた宿主植物に感染していないと死んでしまいます。宿主が死んでしまうと自らも生存できませんので、宿主を殺さないような感染戦略をとる必要があります。多くの植物病原糸状菌も最初は宿主を殺さず栄養を奪いますが用が済んだら殺した上でさらに栄養として吸収しますし、最初から殺しにかかる荒々しいものもいますが、うどんこ病菌は最後の最後まで宿主を殺さないようにしながら生きながらえようとします。ですので、多くの植物病原糸状菌が培地で人工培養できるのに対し、うどんこ病菌は植物に感染させ続けないと維持培養できません。本研究室の人工気象器内で代々維持培養しているうどんこ病菌はオオムギに感染させ続け、もう70年を超えています。 もうひとつの面白い特徴は、植物の表皮細胞にのみ感染するということです(ごく一部例外あり)。他の植物病原糸状菌は表皮細胞を突き破って葉組織内の葉肉細胞にどんどん感染して光合成産物を強奪していきますが、うどんこ病菌は吸器という栄養吸収器官を表皮細胞内のみに形成しておとなしくお裾分けをもらっています。ですが、うどんこ病菌は感染拡大力が非常に強く、防除しなければ重大な病害となってしまいます。なぜなんでしょう?感染戦略を分子レベルで解明すればその答えがわかるはずです。
1細胞レベルで感染戦略を視る
オオムギうどんこ病菌の細胞学的実験技術
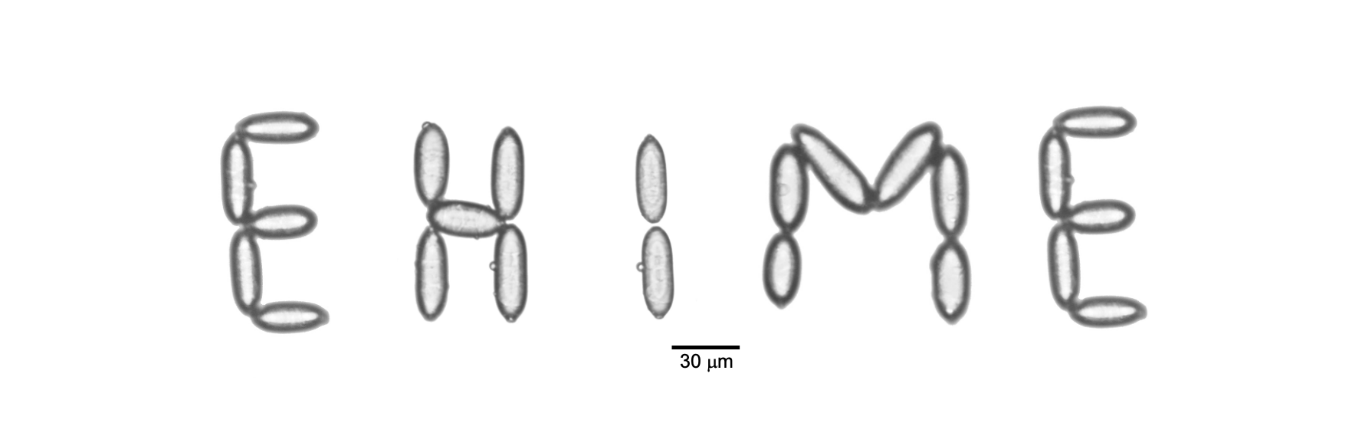
オオムギうどんこ病菌の分生子は楕円形で、他の植物病原菌とは異なり、大きさが約10 x 30 μm とかなり大きく、また、ほとんどの植物病原糸状菌の形態形成が100%近い湿度条件または水中で行う必要性があるのに比べて、本菌の場合70%程度の低い湿度条件で、発芽から侵入、分生子形成といった形態形成を全うすることが可能です。このような特性のおかげで、マイクロマニピュレータなどで物理的に菌体をつり上げたり他の細胞に移動させたりすることができます。上の写真のように分生子で文字を描いたりもできます。さらに、表皮細胞にしか感染しませんので、オオムギ子葉鞘の表皮細胞を一層だけに調整し、その上で菌がどのように行動するのかをリアルタイムで観察することができます。他の植物病原菌の場合は染色したり細胞を固定する必要があったり、葉組織の内部にまで侵入するために顕微鏡では観察できなかったりしますので、感染行動を解析するのが困難なことが多いのが現状です。植物病原菌と単一層の表皮細胞を用いたリアルタイム実験系は、他の植物病理学分野ではほとんど例がなく、オオムギうどんこ病菌ならではのものであり、私たちの研究室では、レーザー熱膨張式マイクロインジェクションを活用して狙った1つの細胞に遺伝子導入したり、蛍光タンパク質やセンサータンパク質を利用したバイオイメージング解析を行えるように整備しています。

感染戦略の秘密兵器
エフェクターの研究
オオムギうどんこ病菌研究の歴史は古く、これまでの植物病理学の基礎を築くのに重要な役割を果たしてきました。最も研究蓄積の豊富な病原菌といっても過言ではありません。ところが2000年以降に急速に進展してきたエフェクター研究は主にトマト斑葉細菌病菌(Pseudomonas syringae pv. tomato)を中心に行われてきました。なぜかというと、Pstは細菌であるために遺伝子操作がしやすかったからです。また、Pstがモデル植物であるシロイヌナズナに感染できたことも大きな理由のひとつです。遺伝学をベースに次々とシロイヌナズナから抵抗性遺伝子が単離されていき、抵抗性タンパク質(専門的にいうとNLR: Nucleotide-binding Leucine-rich repeat containing Receptor)が認識する非病原性タンパク質、つまりエフェクターも数多く見つかってきました。さらに生化学的な技術が活用されて様々な植物病原菌のエフェクターの病原性機能が分子レベルで解明されつつあります。
そこで満を持してオオムギうどんこ病菌エフェクターの研究を、と思いきやそこに立ちはだかっている問題が「絶対寄生性」と「宿主特異性」です。絶対寄生菌なので人工培養できず、遺伝子操作が非常に困難です。さらに、遺伝学的解析が困難なオオムギが宿主であるといった性質が追い討ちをかけています。私たちの研究室では、オオムギうどんこ病菌がどのようなエフェクターを持ち、そのエフェクターがどのように分泌され、どのように宿主細胞へ侵入するのか、どのような病原性機能を持つのか、さらにはどのように植物は防御するのか、これらの謎を明らかにすることを目的として、研究室で長年蓄積してきたオオムギうどんこ病菌の知見に遺伝子組換えやタンパク質工学などの分子生物学的技術を取り入れて研究しています。現在はプロテオーム解析によりエフェクター候補タンパク質を多数発見しており、病原性機能をひとつずつ分子レベルで解析しています。

宿主細胞への侵入の謎
なぜカルシウムイオン?
絶対寄生菌であるがゆえに、分生子が宿主表皮に付着したらすぐさま発芽して侵入し、宿主から栄養を摂らないと死んでしまいます。分生子の中には侵入を試みるための1度きりのエネルギーしか入ってませんので、いかにして高確率で侵入を成功させるか、高度に進化してきたことは想像に難くありません。他の植物病原糸状菌とは全く異なる仕組みで侵入しているのではないでしょうか。
オオムギうどんこ病菌が侵入するためには、宿主の表皮細胞内にカルシウムイオンが流入する必要があることが以前から知られていました(Kobayashi et al., 2007)。カルシウムイオンの流入は、多くの病原菌に対して植物が防御反応を引き起こす際に起こる現象としてよく知られているのですが、オオムギうどんこ病菌はなぜそれを必要とするのでしょうか?むしろそれを抑制したいと考えるのが普通ではないでしょうか?その謎を紐解く研究として、MLOというオオムギのタンパク質を解析しています。MLOの機能を制御する仕組みやカルシウムイオン流入の意義については今後の報告が待たれるところです。植物が本来持つ仕組みや共生を真似しているのではないのか?という視点で、研究室の総力を上げて続報を出せるよう頑張っています。
参考文献:
Yaeno, T., Wahara, M., Nagano, M., Wanezaki, H., Toda, H., Inoue, H., Eishima, A., Nishiguchi, M., Hisano, H., Kobayashi, K., Sato, K., Yamaoka, N. (2021) RACE1, a Japanese Blumeria graminis f. sp. hordei isolate, is capable of overcoming partially mlo-mediated penetration resistance in barley in an allele-specific manner. PLOS ONE 16: e0256574
Koide, H., Hisano, H., Yaeno, T. (2023) CRISPR/Cas9-based generation of mlo mutants for allelic complementation experiments to elucidate MLO function in barley. Journal of General Plant Pathology. s10327-023-01120-w

グリーンバイオニシア
緑の属国
多くの病原菌は植物に感染すると、最終的にネクロシス(壊死)を引き起こします。一方でオオムギうどんこ病菌の場合は、絶対寄生菌であるため可能な限り宿主を生きながらえさせようとしているせいか、ネクロシスは引き起こさず、次第に葉が黄化(クロロシス)していきます。最終的には枯れてしまいますが、その頃には無数の分生子を形成して拡散してしまった後なのでミッション達成なのでしょう。さて、そのクロロシスですが、どうやら宿主側が引き起こしているのではないかということがわかってきました。宿主としては侵入者が絶対寄生菌ですので、感染した葉をできるだけ早く枯らすことで菌の栄養吸収・繁殖を抑え、他の葉を守りたいのかもしれません。それに対してオオムギうどんこ病菌は、侵入した細胞の周囲の細胞がクロロシスを起こすのを抑制し、緑色のままにして強制的に光合成させ続けます。まるで海に囲まれた緑豊かな島国のように見えることからこの状態をグリーンバイオニシア(緑の属国)と呼んでいます。オオムギうどんこ病菌がこの現象をどのようにして引き起こしているのかを分子レベルで解明しようと挑戦しています。このプロジェクトは、令和4年度の科学研究費助成事業 学術変革領域(B)に採択され、「プラスチド相転換ダイナミクス」のA04課題として進めています。
詳しくはプラスチド相転換ダイナミクスをご覧ください

TILLING
オオムギをシロイヌナズナのように
シロイヌナズナの全ゲノムが解読される前から変異体スクリーニングしていた人間としては、T-DNAタグラインや既報の変異体をABRCやNASCから取り寄せるのが当たり前のようになっていました(しかも低価格で)。研究対象の遺伝子の機能解析をしたい場合はTILLING法で変異体アレルを探すことだって躊躇わずできていました。形質転換も簡単にできますから過剰発現体、発現抑制体なんて思い付いたらすぐに作っていましたし、今ならゲノム編集も可能です。オオムギを研究対象にしてからはその状況の方がおかしかったのだと痛感しました。シロイヌナズナ研究は恵まれ過ぎていました。オオムギでは遺伝子操作のあらゆることが難しいですし、欲しいと思ったものがそう簡単には手に入りません。そんな状況にもかかわらず、不幸なことに、難しい道をあえて選んでしまうという損な性格がひょっこり顔を出し、「じゃあ自分でどうにかしよう」と考えてしまいました。親譲りの無鉄砲で子供の頃から損ばかりしています。もう引き返せない旅に出てしまっています。うどんこ病研究に適したオオムギ品種で欲しいと思った変異体をすぐに単離できるようにするために、次世代シーケンサーを使ったTILLINGスクリーニング系を自前で確立すべく、すでに約8,000系統の変異体集団からゲノムDNAを抽出して種子と紐付けしてストックしています。もう少しでスクリーニングして変異体を取れるようになりますので温かい目で見守ってください。
